はじめに
2019年8月に、改訂版《中華人民共和国薬品管理法》の中で薬品上市許可所有者制度(MAH)が言及されて以降、MAHに関する話題は業界内で一般化された。
そんな中、外資系製薬メーカーにとって注視しているのが、MAH国内代理人対応についてだ。
以下スライドは、2020年8月に発表された《国外薬品上市許可所持者国内代理者管理暫定規定(意見募集稿)》をまとめたものだ。
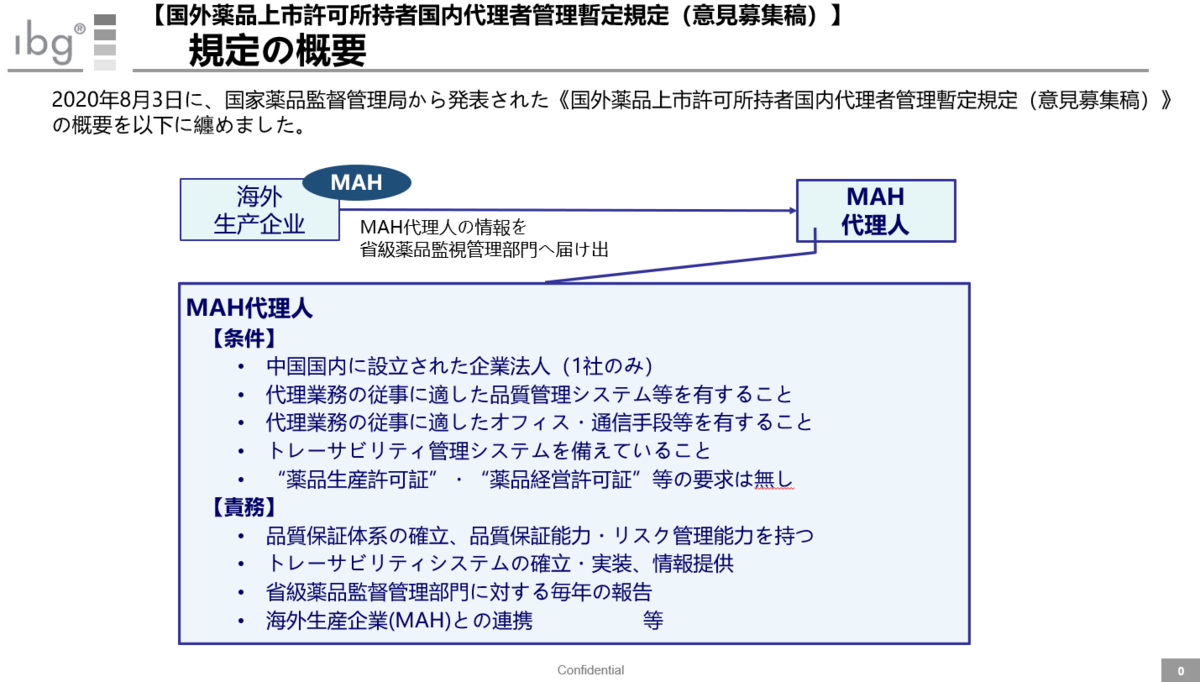
意見募集稿(パブリックコメント)として出されたこちらの規定。
「MAH代理人が1社のみに限定されるのか?」など、正式版が発表されるまで不確定な状況にあるものだ。
MAH対応に関して、今回は簡単にイメージ化したので紹介したい。
MAH対応 全体業務イメージ
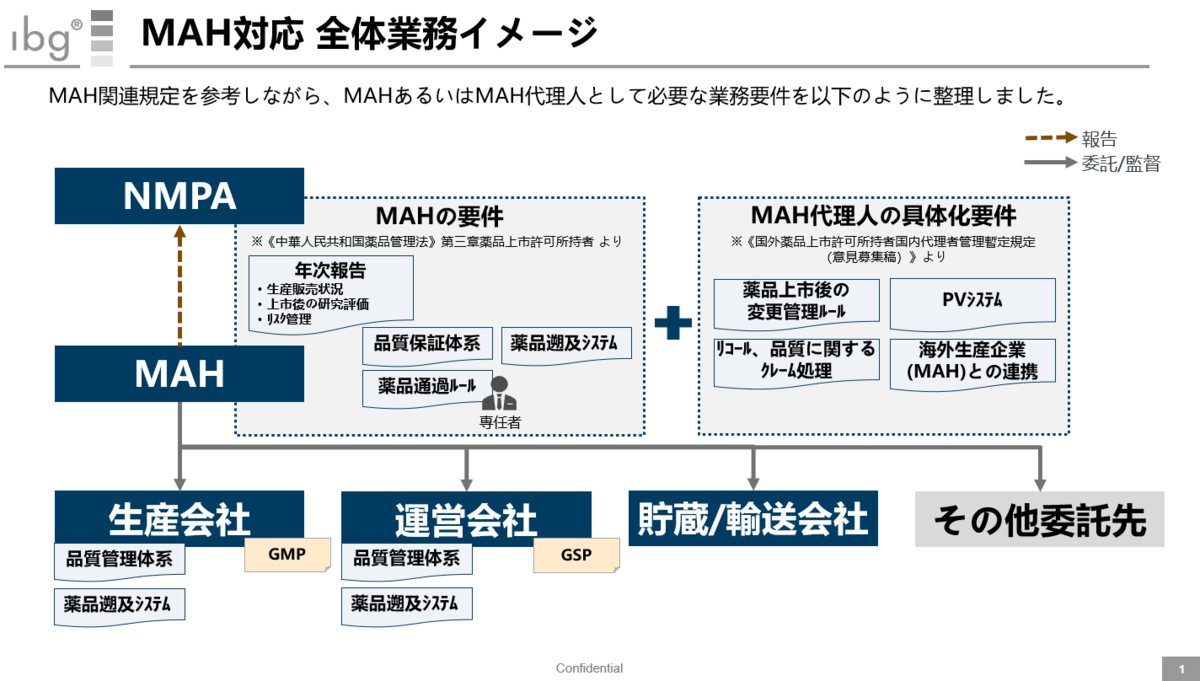
こちらは《中華人民共和国薬品管理法》や《国外薬品上市許可所持者国内代理者管理暫定規定(意見募集稿)》を参考にしながら、MAHがNMPAに対して報告すべき内容、及びそれを行うためのステークホルダーとの関係図をまとめたものだ。
特に右上にある「MAH代理人の具体化要件」は、未だパブリックコメントの状況なので、いつまでに対応すべきか不明な状況だが、対応プランは用意している状況だ。
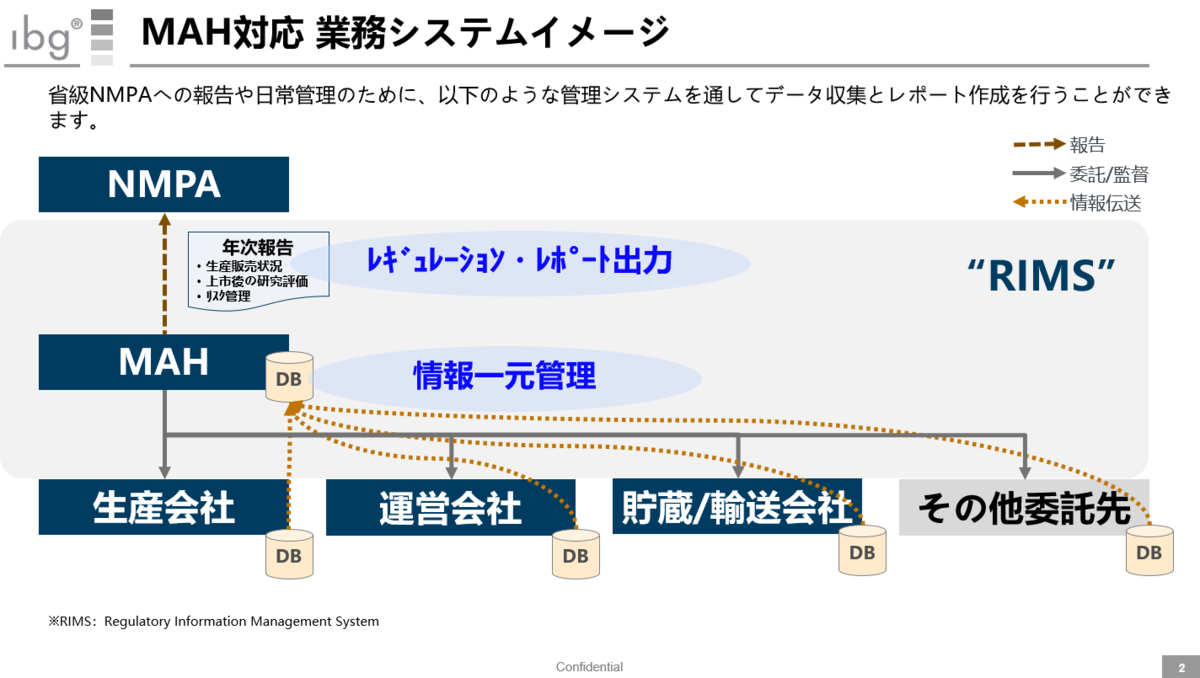
こちらは業務システムの“イメージ”をまとめたものだ。実際にMAH国内代理人がトレーサビリティシステムを全て持つのは難しく、外部の協力会社と連携した形になると考えられる。
ポイントはシステム導入自体ではなく、これらを情報管理できる業務上の仕組みを如何に作っておくかと言える。
さいごに
中国では2015年頃、医薬品の電子監督管理が強化されていた。
具体的に言うと、「全ての医薬品卸・販売企業は《医薬品経営品質管理規範》の要求に従い、取り扱い医薬品の全てのコードをスキャンし、データを提出しなくてはならない」というものだ。プラットフォームとして、阿里健康(AliHealth)のものが使われ、その際バーコードシステム対応した製薬メーカーも少なくないと思う。
当時は2016年からの強制実施が図れていたが、民間の阿里健康(AliHealth)が運営することによる公平性欠如を求める声が出たため、取りやめた経緯がある。
今回のMAH対応について、いつ施行されるのか?どのレベルまで要求されるのか? など、現状では見えづらい点もある。
そんな中、プラン作りとその見直しを高速で回していく必要のある中国事業。先が見えないからこそ、面白い点もあると考えられる。
以上
この記事は各種公開情報・ibg経験等を基に、ibgが内容を作成したものです。
