はじめに
少し前の話となるが、2021年5月21日に国務院から《医薬品監督管理能力の全面的強化に関する実施意見書》が発表された。
これは、2021年2月に習近平国家主席も参加した中央全面深化改革委員会での検討内容を、国務院が文書化して発表したものだ。
今回発表された《医薬品監督管理能力の全面的強化に関する実施意見書》の構成は以下となっている。
一、全体要求
二、重点任務(18の重点任務)
三、保障措置
今回は「二、重点任務」の内容を紹介したい。
様々なトピックが記載されているが、「監督管理」に関する今後の傾向を掴む上で参考としていただきたい。
「二、重点任務」の内容
1.法律法規の改善
《中華人民共和国医薬品管理法》、《中華人民共和国中医薬法》、《中華人民共和国ワクチン管理法》、《医療機器管理条例》、《化粧品管理条例》等の完全実施のため、関連する法規規則の制定改正を迅速に行う。適時、規範性文書の改善、技術指南の制定改正の推進、より良いシステムを完備した医薬品管理法律法規制度体系を構築していく。
2.管理能力レベルの向上
政府主導、企業主体、社会参与型基準システムを早急に強化、また国家医薬品レベル向上計画を継続する。医薬品基準システム構築、基準管理制度に関する措置の強化、全プロセスを通して基準の制定改正に関する管理の精密化を目指す。医療機器基準システム強化、化粧品基準システム構築においては、国家基準・業界基準・団体基準・企業基準の調和をとり、積極的に国際基準との協調を行い国際的な基準と同程度まで水準を引き上げる。
3.技術評価能力の向上
国家区域協調発展戦略に照準を合わせ、現状のリソースを整理。漢方およびバイオ医薬品(ワクチン)等の審査検査機関を設置し、また専門的な技術力の向上を図る。
新薬や医療機器の開発と審査システムを連動させることにより、新技術応用や新製品研究開発をサポートする。
審査決定における専門化諮問委員会の役割を発揮し、専門家の意見や審査結果報告を公開する。
臨床で必要な海外上市済み医薬品の輸入制度を整備する。
国家医薬品毒物学協同研究メカニズムを構築し、医薬品における危険物質の識別、規制を強化する。
4.漢方審査の合理化
漢方の開発規則に従い、漢方の理論・臨床試験を結び付けた独自の審査システムを構築する。
またエビデンスに基づく医学応用を重視し、リアルワールドデータ研究を模索する。
また、漢方登録分類の最適化、全プロセスにおける品質コントロールを行う。
5.検査システムの強化
職業化・専業化した医薬品検査チーム設立に向けて、関連部署は各級医薬品管理業務に必要な検査チーム体制を早急に構築する。とりわけ、新型コロナウイルス対策や重大案件の調査中に露呈した問題に関しては、各省(自治区・直轄市)の現状のシステムを強化し、検査チームを拡充することで対応する。新たな検査方式方法については、突貫性および実効性を重視する。また、検査能力を均等にする人員配置システムの構築を目指す。
6.調査処理システムの強化
医薬品調査チームを設立し、省級市場管理と医薬品管理システムの強化を図る。市県医薬品管理能力の標準化推進のために、専門管理員・予算・設備等の最適分配を行う。
また、各級医薬品管理部門は公安機関と連動し、適時重大案件情報の提供や嫌疑案件の連携を行い、特にワクチン法に違反する行為に対しては厳罰に処する。
7.管理部門の連携強化
地域や等級を跨いだ医薬品管理協力体制の強化に向けて、国家・省・市・県の管理責任部門で、医薬品の全プロセスにおいて協力した管理を行う。
8.検査能力の向上
国際的な最先端技術に照準を合わせ、中国食品医薬品検定研究院をトップ、国家薬監局重点実験室を中核、省級検査機関に依頼する形で、科学的権威のある医薬品・医療機器・化粧品検査システムの構築を図る。
新型ワクチンやバイオ技術製品の評価・検定を推進する国家重点実験室を設置し、国家実験室システムに組み込む。
9.バイオ製品(ワクチン)承認能力の向上
中国食品医薬品検定研究院のバイオ製品(ワクチン)承認能力アップのため、法規の条件に合致した省級医薬品検査機関を国家バイオ製品(ワクチン)承認機関に指定する。
10.国家医薬品警戒システムの構築
医薬品・医療機器・化粧品の不良反応監視測定システム構築および省、市、県級医薬品不良反応監視測定基準制定の強化を行う。
11.化粧品リスク監視測定能力の向上
化粧品の技術審査、抜き取り検査、現場検査、不良反応の監視測定、世論調査等におけるリスクデータをまとめ、統一のリスク監視測定システムを構築し、連動性のある業務システムを形成する。
12.応急管理システムの強化
各級人民政府の医薬品安全に関する事前対策を強化し、応急管理システムを整える。
突発的な重大公共衛生案件の対処における検査・システム検証・審査・監視測定の評価等の業務について、統一的な指導・協力の強化を行う。
また、国家薬監局安全応急訓練センター設立により、医薬品安全応急訓練を常態化することで、各級医薬人管理責任機関の応急処理能力アップを図る。
13.トレーサビリティシステムの強化
トレーサビリティ可能な統一の医薬品データ化基準を制定し、医薬品のコード管理を実現。上市許可保有者までのトレーサビリティを可能にする。
全国医薬品トレーサビリティ協同プラットフォームを構築し、生産・流通・使用等の段階ごとの情報を整理する。ワクチンや血液製剤、特殊医薬品等から開始し、徐々に拡大を目指す。
14.全プロセスデジタル化管理の推進
医薬品・医療機器・化粧品の管理におけるビッグデータ活用を強化し、実験室から末端の利用者までの全過程のデータ収集、情報の共有等の能力を向上させる。
ビッグデータに基づくキーとなる共通性をもつ技術や応用を研究模索し、産業のデジタル化アップグレードを図る。
15.“インターネット+医薬品管理”サービスレベルの向上
ワクチン・血液製剤・特殊医薬品等の分野で医薬品管理とインターネットを融合応用する。医薬品登録電子通用技術ドキュメントシステムや医療機器登録電子届出データ化システムを構築し、審査や証明書管理のデータ化、オンライン化を推進する。化粧品分野の管理についてもインターネットを活用し、業務効率やサービスレベルの向上を図る。
16.中国医薬品管理科学行動計画の実施
世界の医薬品管理最前線を参考に、管理政策の強化や高等院校・科研機関等の医薬品管理科学研究基地設置により、新たな管理手段・新基準・新方法について研究、活用を図る。
医薬品管理科学研究は国家関連科技計画に組み込まれ、主に漢方、バイオ製品(ワクチン)、遺伝子薬物、細胞薬物、人工知能医療機器、医療機器新材料、化粧品新原料等の分野の研究を行う。
17.管理チームの資質向上
管理チームの年齢や専門性の最適化を図る。重点的に高等審査員・検査員の教育を行い、国際的な人材教育育成や管理の中核となる人材確保を目指す。
各省(自治区、直轄市)において、実際の状況を鑑み、職業化専門家された検査員教育方案を作成し、省・市・県各級医薬品管理員の教育訓練を強化する。地域による管理能力格差を減らす。
18.管理 国際レベルまで向上
医薬品管理に関する世界的な需要に適応するため、国際的な協力システムに深く関わり、国際規則の制定に積極的に参加する。国際経験を参考に国家医薬品品質管理システムを整え、地方の管理能力アップを図る。京津冀、粤港澳大湾区、长三角等の地域の医薬品管理能力を率先して国際的な先進水準まで引き上げる。
「13.トレーサビリティシステムの強化」について
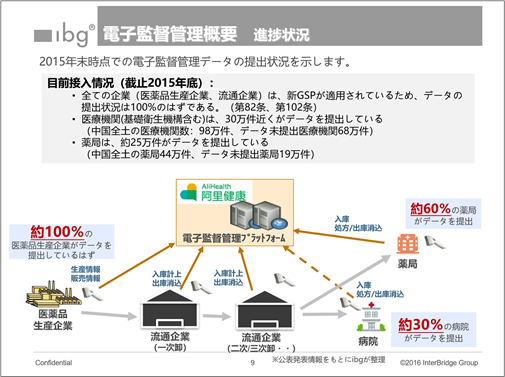

上記2枚のスライドは、2016年初に作成したものだ。
トレーサビリティシステムの強化というと、当時のことを思い出す。
・AliHealthでの電子監督管理プラットフォーム上で管理すべく、政府主導で医薬品のコード管理等を推進。
・公平性の不足(民間企業によるデータ一元管理)といった反対意見が出たため、2016年2月にCFDA(国家薬品監督管理局)は当執行の停止を決定。
「トレーサビリティシステムの強化」の1つをとって見ても、過去の様々な経緯があり、今後どのように推進されるのか注目してしまう。
さいごに

上記スライドは、国務院所属の関連省庁をまとめたものだ。
ヘルスケア業界と関連の深い3省庁(国家衛生委員会・国家薬品監督管理局・国家医療保障局)は青字で塗っている。
この組織構成を見ていただければ分かる通り、国務院から大方針が出された後、各省庁からそれに基づく施策が策定されるのが、中国における政策発表までの流れだ。
今回発表された、医薬品監督管理能力向上に関する18の重点任務について、今後の動向にも注目していきたい。
以上
この記事は各種公開情報・ibg経験等を基に、ibgが内容を作成したものです。
