はじめに
2021年1月26日に、本ibgHealthcare Newsで以下のスライドを配信した。
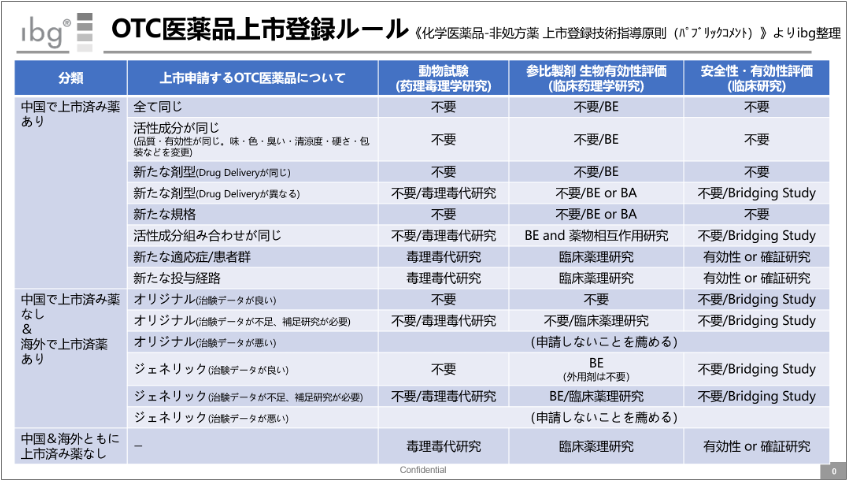
これは、2020年7月6日に出された《化学医薬品-非処方薬 上市登録技術指導原則(パブリックコメント)》をまとめたものだ。 まだパブコメの状態で、中国でOTC医薬品の上市承認をとるのは未だ簡単なことではないと言える。
今回はOTC医薬品繋がりで、スイッチOTC(処方薬→OTC薬)に関する状況を共有したい。
処方薬⇒OTC薬の承認取得要件
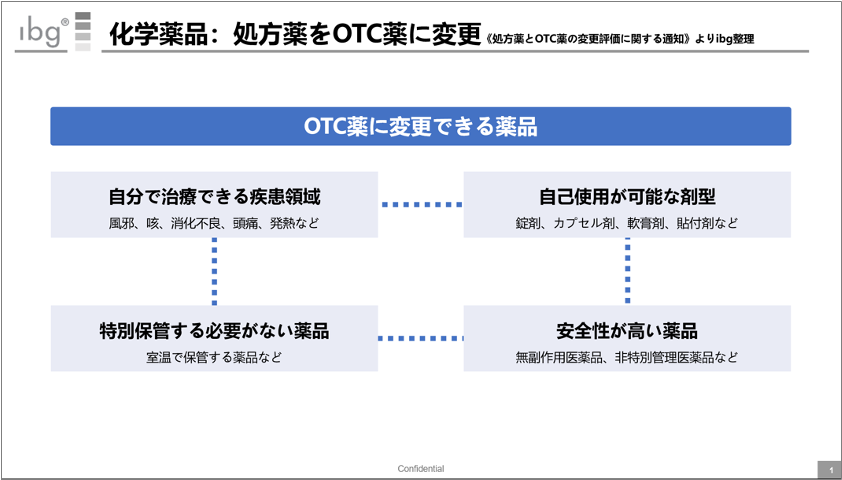
スイッチOTCに関しては、《処方薬とOTC薬の変更評価に関する通知(关于开展处方药与非处方药转换评价工作的通知)》にて定められている。
上記は、OTCへ変更可能な医薬品の条件をまとめたものだ。
一般的な考え方同様、医師による診断が不要だったり・安全性が高かったりする処方薬が、OTC薬へスイッチしやすい状況だ。
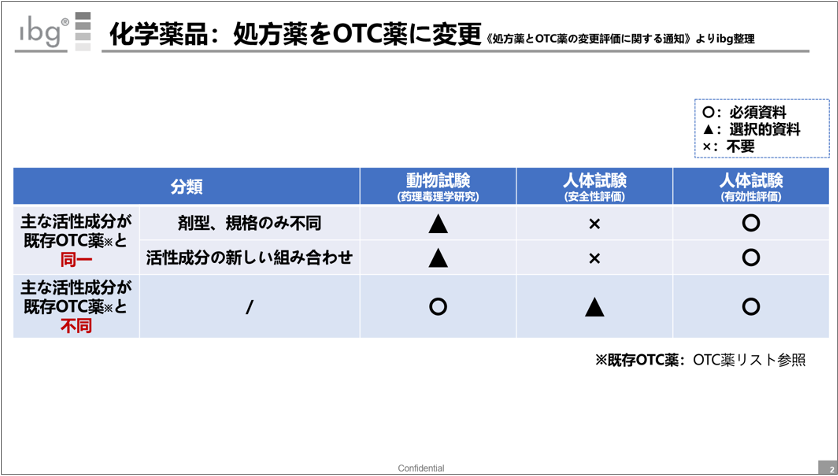
こちらは、スイッチを申請する際の要件をまとめたスライドだ。
主要成分が既存OTC薬と同一か否かで、求められる試験内容が異なる。
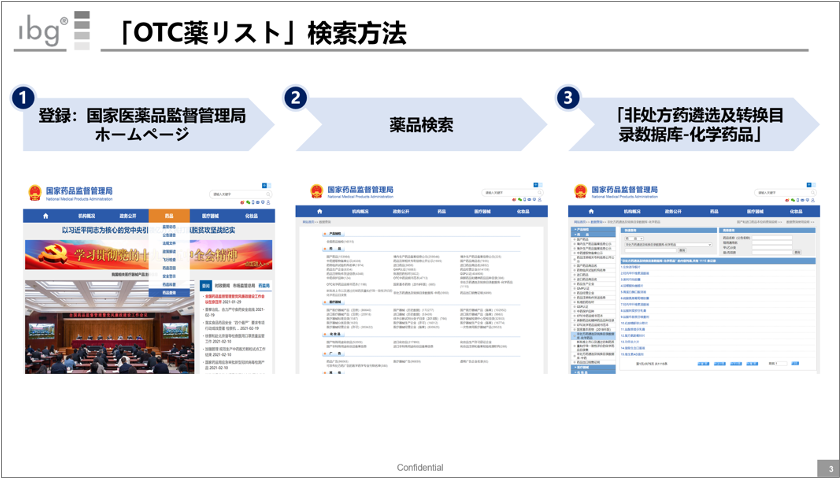
ちなみに前スライドで挙げた「既存OTC薬」だが、上記の方法で確認可能だ。
さいごに
OTC薬市場は、店舗薬局との小売価格交渉・手数料交渉などが難しい。
中国大手ローカル企業のような売り筋製品を持つ企業ならいいが、そうでなければ薬局市場で多くの利益を上げるのは簡単ではない。
今回は製品上市承認に関する記事だったが、それ以外にもマーケットアクセス・流通・マーケティング・プロモーション・生産など、それぞれにクリアすべき課題はある。
今回の記事が、少しでもお役になると幸いです。
以上
この記事は各種公開情報・ibg経験等を基に、ibgが内容を作成したものです。
