はじめに
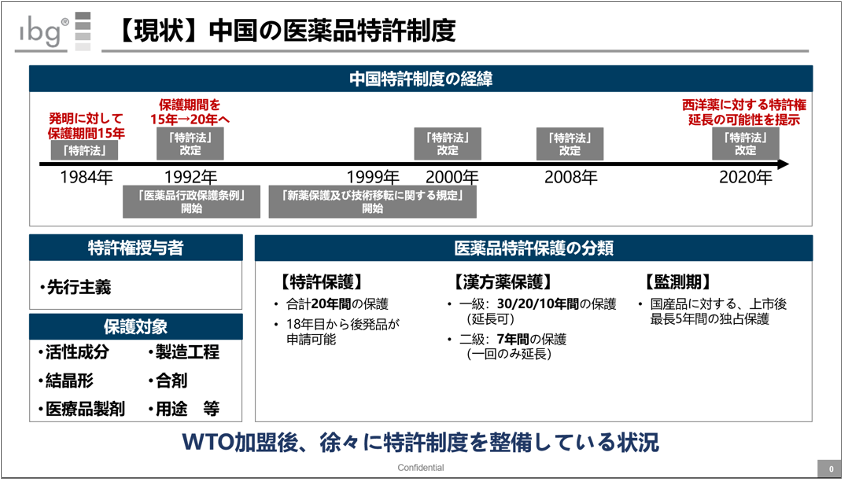
上記スライドは、中国における医薬品特許制度の概要をまとめたものだ。
特許法が制定されたのが1984年。その後、経済成長・WTO加盟等を経ながら少しずつ改定されてきた。次のスライドに示すが、2020年の全人代では西洋薬に対する特許権について提示されている。

2021年6月1日から施行される改訂版特許法では、上記のような延長の可能性が提示されている。詳細な算出方法がまだ正式発表されていない状況だが、引続き注視していきたい。
医薬品特許紛争早期解決システム行政裁決弁法(意見募集項)
2021年2月9日、国家知識産権局(ChinaNational Intellectual Property Administration)より《医薬品特許紛争早期解決システム行政裁決弁法(意見募集書)》が発表された。
医薬品特許の権利保護を目的とした弁法で、現状パブリックコメントの状態だが、この中では2021年6月1日からの施行が明記されている。
本パブリックコメントは全22条で構成されている。参考に、内容を以下にまとめた。
【第一条~第三条 概要】
・《中華人民共和国特許法》および関連法律・法規・規定に基づき、本弁法を制定する
・国家知識産権局が行政裁決業務を行う
【第四条 申請条件】
・申請できるのは、特許権所有者・医薬品上市許可申請者(MAH)・特許使用権所有者
・被告人・申請内容・具体的事実・理由が明確であること
・特許情報が中国上市医薬品特許データプラットフォームに登録済みであること
・これまでに当該医薬品特許紛争の申請がないこと
【第五条 申請提出書類】
・申請書および必要資料(主体の資格証明・特許の登録情報など)を提出
【第六条 申請書類の記載内容】
・申請者の氏名/名称、住所等基本情報
・被告人の氏名/名称、住所等基本情報
・登録された特許情報(特許番号、特許種類など)
・申請医薬品の情報
・特許侵害にあたる理由
・証拠資料リスト
・申請者の署名或いは社印
【第七条 登録および審査】
・申請書類受領後、登録および審査を開始する。資料に不備がある場合は申請者に通知し、期限内に追加提出を求める
・規定のフォーマットを使用していない場合や、記載内容が規定と一致しない場合や、規定に沿った資料の添付が無い場合は、申請がないものとみなす
【第八条 受理・通知をできない場合】
・申請書に申請者姓名等の基本情報が記載されていない場合や、被告人が不明確な場合や、当該特許が中国上市医薬品特許データプラットフォームの対象種類に登録されていない場合は、申請を受理せず申請者への通知も行わない
【第九条 申請の立案・通知】
・不備のない申請を受理した後、国家知識産権局は規定の期間内に立案し、申請者および被告人に対して通知する
【第十条 事実確認】
・審査の過程で必要な際は、国家知識産権局は薬品監督管理部门に事実確認を行う
【第十一条 審査通知方法】
・国家知識産権局は、申請の状況に応じて書面審査か口頭審査のいずれを行うか決定する
・口頭審査の場合は、3営業日前までに当事者へ通知する。申請者が正当な理由なく欠席/途中退席する場合は、その申請は撤回されたものとみなす。被告人が正当な理由なく欠席/途中退席する場合は、欠席として審査を行う
【第十二条 無効判決】
・特許の権利内容が全て無効と判決された場合は、国家知識産権局は行政裁決請求を却下する
【第十三条 調停】
・当事者の希望により調停を行うことができる。調停が成立した場合は、調停書を作成する。調停が不成立の場合は、行政裁決を行う
【第十四条 審議の中止】
・当事者の一方が死亡した場合や、当事者の一方が裁決の履行能力を喪失した場合や、当事者の法人が閉鎖された場合などは、当事者が審議の中止を申し出ることができる。
【第十五条 申請の撤回】
・裁決の前であれば、申請者は申請を撤回することができる。その際当該案件は終了となる
・裁決が決定された後の撤回については、裁決の内容は有効となる
【第十六条 範囲】
・審議中に上市申請された医薬品技術方案について、国家知識産権局は当該特許の保護範囲に該当するか判断する
【第十七条 不服の場合】
・当事者が決定された裁決に不服の場合は、15日以内に人民法院に起訴することができる
【第十八条 守秘義務】
・当事者は、証拠資料等の真実性に責任を負う
・当事者は審議の過程で知り得た情報について、守秘義務を負う
【第十九条 担当者の守秘義務違反】
・担当者が守秘義務を犯した場合や、犯罪行為である場合は法に基づき処分を行う。犯罪行為の疑いがある場合は、司法機関に移送し処分を行う。
【第二十条 本弁法未制定期間の取扱い】
・本弁法が制定されるまでは、《特許行政執行弁》および関連規定に基づく。
【第二十一条 解釈の責任】
・本弁法の解釈の責任は、国家知識産権局が負う。
【第二十二条 施行】
・本弁法は2021年6月1日から施行される。
以上
この記事は各種公開情報等を基に、ibgが内容を作成したものです。
